2. 免疫蛍光染色
一般的なワークフロー
すべての免疫蛍光染色プロトコルは4つの主要な段階(培養、固定、染色、イメージング)からなり、以下のように細分することができます:
免疫蛍光染色は繊細な方法であり、多くの工程に結果を左右するポイントがあります。このため、プロトコルをわずかに変更するだけでも、異なる結果を導く可能性もあります。そこで、免疫蛍光染色では、特定のプロトコル(例えば、細胞密度、抗体濃度、反応温度、反応時間)で正確に同じ条件を維持することは非常に重要となります。以後、間接免疫蛍光染色プロトコルにのっとり概要を示します。
ibidi Solution
底面がカバースリップで出来ているibidiマイクロスライドとマイクロディッシュは、倒立顕微鏡観察に適しており、さまざまな免疫細胞化学のニーズに答えるために、さまざまな形状のものを用意しています。これらの容器では、すべての免疫蛍光染色ステップを、スライドまたはディッシュ中だけで実施することができます。
ibidi チャネルスライドの形状は、免疫蛍光染色で少量の培地を扱う際に適しています。底面がカバースリップボトムであるためは、染色後はカバーガラスでサンプルを封入する必要がありません。
ibidi チャンバースライドでは、細胞培養用のチャンバーを複数備えたシリコーンフレームを一般的なスライドガラスに取り付けています。このスライドは、カバーガラスでサンプルを封入することができ、染色サンプルの長期保存に適しています。
一般的な細胞培養に使用されるプラスチック材料とは異なり、ibidi製品は、有機溶媒に適合でき、固定操作に対応しています。詳細は、リンクの化学物質適合性表をご確認ください。このため、ibidiポリマーというプラスティックを使用しているにもかかわらず、すべての免疫蛍光染色ステップを、スライドまたはディッシュ中で直接実施することができます。
01.サンプル準備
免疫蛍光染色をはじめる前に、使用する細胞における対象とするターゲットタンパク質の発現レベルおよび細胞内局在を文献調査で確認するとよいでしょう。タンパク質の中には、特定の細胞株で、極端に発現量が非常に低いものがあります。このような場合、外部からの刺激や、なんらかの過剰発現技術で対象のタンパク質発現を促す必要が生じます。
また、染色に最適な細胞密度も検討しなければなりません。一般に、免疫蛍光染色には70~80%のコンフルエンス状態が推奨されます。 さらに、理想的な細胞培養容器の形状、及び基質/コーティングを選択し、使用する顕微鏡観察法と互換性を持たせる必要もあります。免疫蛍光染色を上手く行うためには、実験全体を通じて、細胞を乾燥させないことも極めて重要です。容器の形状を選択する際には、この点も含めて考慮すべきです。
最後に、適切な比較対照群考慮し、染色後、統計学的有意差検定を行うために必要な試料数を前もって計画すべきです。
02.サンプル固定
免疫蛍光染色プロトコルの第一段階は、試料を固定することです。この工程は、通常、試料を4%ホルマリン溶液(PBS、pH 7.4)中で室温、10分間インキュベートします。冷却したメタノールまたはアセトンで固定することもできます。
しかし、最適な固定条件は、実験ごとに個別に決めるべきです。メタノール固定によって破壊されるタンパク質もあれば、ある種の抗体はホルマリン固定された試料中では機能しない抗体もあります。固定後、洗浄液(PBSなど)で試料を5分間、3回洗浄し、固定液を完全に除去することも非常に重要です。
03.細胞透過処理
細胞内のタンパク質を染色するためには、細胞は透過処理を必要とします。この段階がなければ、抗体が脂質膜を通って細胞内に入ることはできません。透過処理には、PBS溶液中でのTritonX-100や(透過性がそれほど強くない)Tween-20などの界面活性剤中にインキュベーションします。 この透過処理でも、対象となるタンパク質、使用した抗体、実験条件に応じて最適化が必要になります。膜タンパク質を染色する際には、Triton X-100が細胞膜を壊す可能性があります。このため、膜タンパク染色には、サポニンを用いる場合があります。アルコールは細胞膜の脂質を容易に洗い流すので、メタノール固定したサンプルは、透過処理済である点はご注意ください。
この段階を経た後、洗浄液で5分間、3回洗浄しなければなりません。
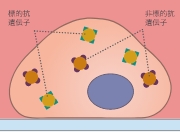
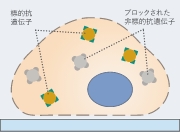
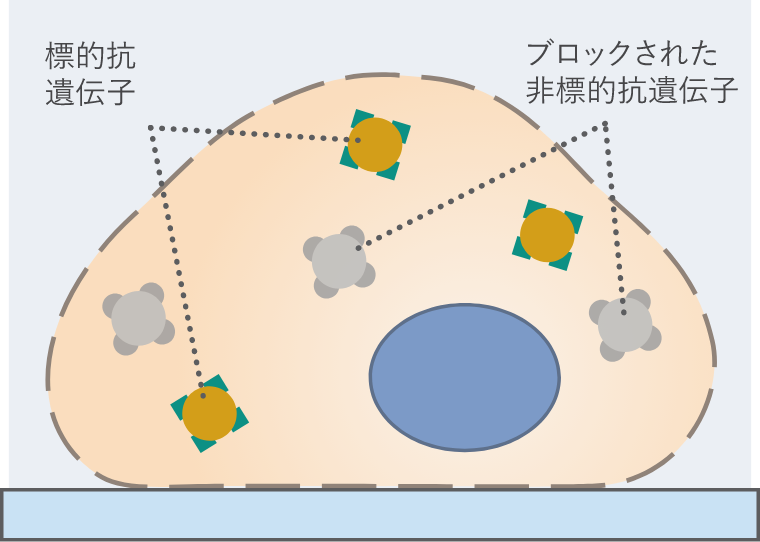
04.ブロッキング
- (1)二次抗体を作った宿主の血清
- (2)ウシ血清アルブミン(BSA)
- (3)ミルク
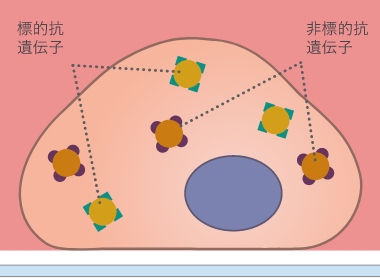
05.一次抗体の抗原抗体反応
一次抗体およびその抗原抗体反応条件の選択は、免疫蛍光染色プロトコルの最も重要なステップです。特に、研究室でまだプロトコルが確立されていない場合には、事前の文献調査が極めて重要です。適切な一次抗体は、対象となる抗原に対して高い特異性を有していなければなりません。さらに、その抗体がモノクローナルかポリクローナルかがその特異性に影響します。多くの抗体メーカーは、免疫蛍光染色で有効であった抗体に関する参考文献を製品ページに掲載しているのでこちらを活用するといいでしょう。
一次抗体でもう一つ確認するべき点は、どの生物に由来するかという点です。この一次抗体のホストで、使用する二次抗体が決まります。このことは、多色染色を行う場合に特に重要です。なぜなら、多重染色する場合、そこで使用する一次抗体は、交差反応を避けるために、それぞれホストが異なっていなければならないからです。 最適な反応条件は実験ごとに慎重に決定しなければなりません。抗体濃度が高すぎてインキュベーション時間が長すぎると、非特異的なバックグラウンドシグナルを生じる可能性があります。逆に、濃度が低すぎる場合や、インキュベーション時間が短すぎる場合には、シグナルが非常に弱くなり、最悪見えない可能性もあります。
一次抗体の抗原抗体反応が終わった後には、試料を洗浄液で5分間、3回洗浄し、バックグラウンドの原因となる未反応の抗体を洗い流します。
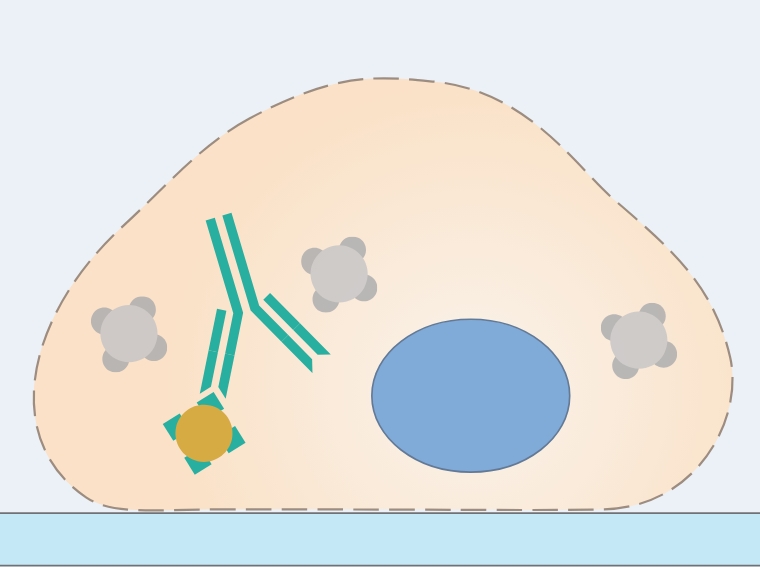
06.二次抗体の抗原抗体反応
標準的な免疫蛍光染色では、二次抗体は蛍光分子で標識されており、これを一定の波長で励起し蛍光観察をします。二次抗体は一次抗体を特異的に認識し結合する必要があります。このため、二次抗体は一次抗体が産生されたホストを特異的に認識する抗体が使用されます。 適切に観察するためには、標識に使用した蛍光色素と互換性がある顕微鏡と装置(フィルター、レーザー、カメラ、検出器)を使用する必要があります。蛍光観察の際には、試料は多数の光子にさらされるので、安定な蛍光分子を使用することが理想的です。また、蛍光分子の輝度も考慮に入れる必要があります。例えば、最も発現レベルの高い抗原は、輝度の低い蛍光分子でも検出であるはずです。また、多色染色をなどでは標識する蛍光分子が変わってくることもあります。多色染色では、使用する蛍光分子のスペクトルの重なりも注意深く考慮すべきです。(このスペクトルの情報は、メーカーのウェブサイトなどに掲載されています。)
二次抗体液中での抗原抗体反応時間は、メーカーのプロトコルに従ってください。蛍光分子は光に敏感なので、ここよりすべてのステップは暗所で行う必要があります。
バックグラウンド蛍光を避けるために、試料は、二次抗体との抗原抗体反応後、洗浄液中で5分間、3回洗浄します。
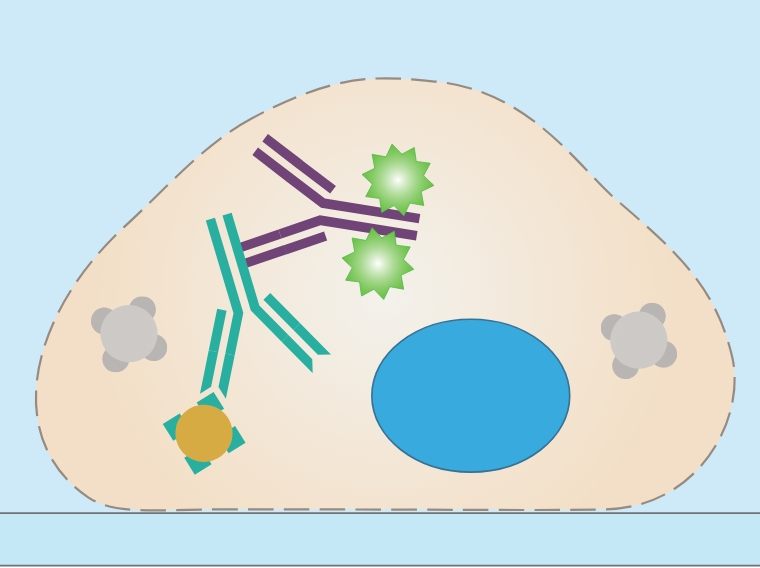
参考:
蛍光分子とは?
蛍光分子(蛍光色素ともいう)は、顕微鏡観察で、特定の構造を標識するのに用いられます。たとえば、緑色蛍光タンパク質(GFP)、赤色蛍光タンパク質(RFP)、黄色蛍光タンパク質(YFP)は、研究に広く用いられている蛍光分子です。
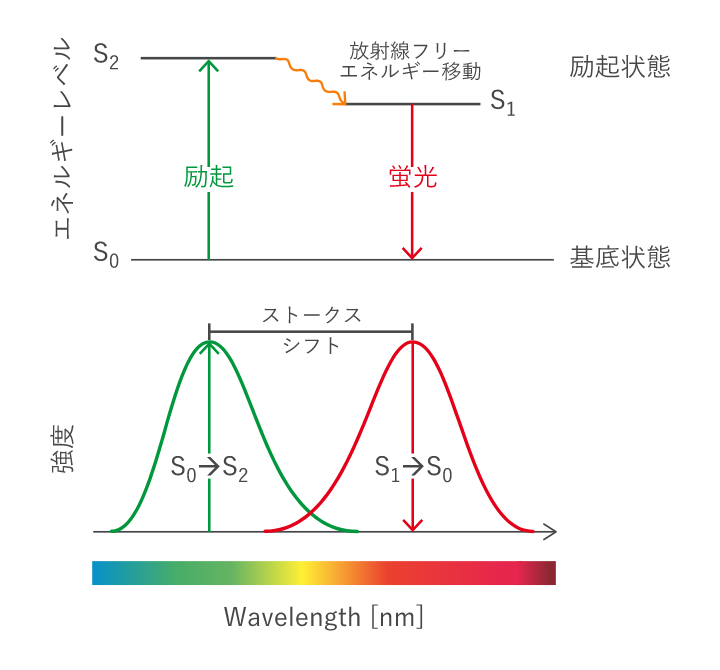
蛍光分子はある波長の光を吸収すると励起し、特定のより長い波長の光を再放出します。励起が起こると、蛍光分子が基底状態(S0)から励起状態(S2)に移行します。この高エネルギー状態は不安定であり、蛍光分子は振動しながら、光を放出し、数ピコ秒後に基底状態に戻ります。この励起状態で起こる振動は、いわゆるストークスシフトの原因となり、蛍光波長は励起波長よりも長い波長となります。
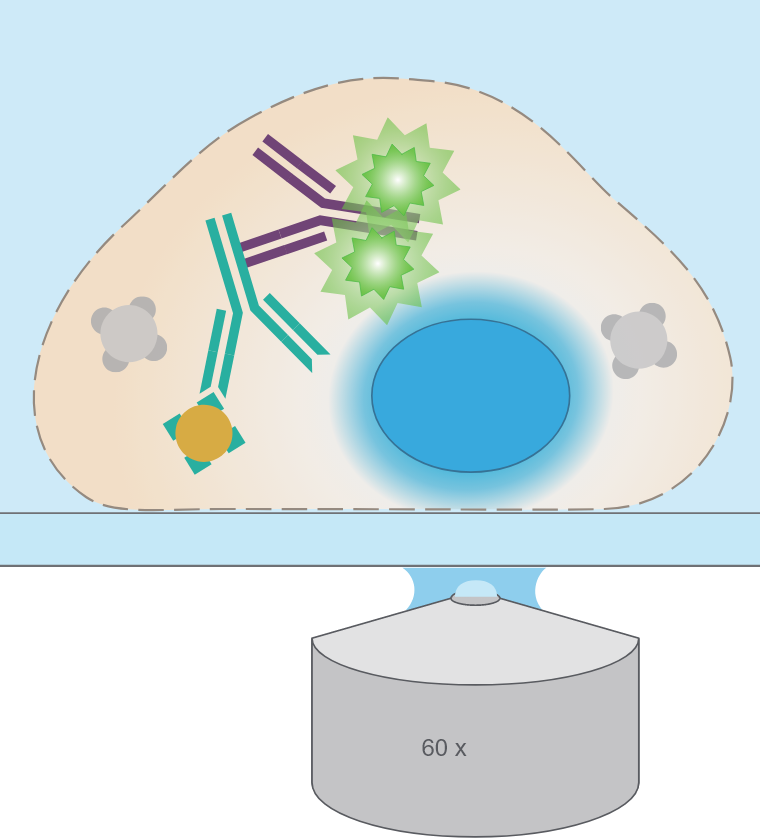
07.対比染色とサンプル封入
顕微鏡観察前の最終段階は、核の対比染色とサンプルの封入です。試料の乾燥を避け、安定した屈折率を得るためには、試料をマウント剤で封入する必要があります。 マウント剤には自家蛍光の低いものを使用してください。DAPIは、核の標準染色試薬であり、マウント剤にあらかじめ含まれており、封入する作業だけでDAPI染色できるものがあります。DAPI染色を別途追加することもできます。

08.顕微鏡観察
サンプルが用意できたあと、観察に適するタイミングは、マウンティング直後になります。 多くの顕微鏡観察手法がありますが、免疫蛍光染色の観察には、通常、落射蛍光法および共焦点顕微鏡法が用いられます。観察に使用する倍率や露光条件などすべてのパラメータは慎重かつ個別に検討してください。
各顕微鏡技術の詳細な概要とその応用については、「ibidiマイクロスライドを用いた顕微鏡観察 」のアプリケーションガイドを参照してください。
ibidi Solution

トラブルシューティング
免疫細胞化学は多くの経験と最適化が必要な非常に繊細な実験です。プロトコルのわずかな変更で、結果が著しく変わる可能性があります。シグナルが低い、検出されない、バックグランドが高い場合は、以下のトラブルシューティングガイドをご覧ください。
バックグラウンドが高い
-
固定が不適切または長すぎるため、アーティファクトにつながる解決策
固定時間の短縮や固定液の変更
-
不十分なブロッキング解決策
ブロッキングの時間を延長する。別のブロッキング液の使用を考慮する。(二次抗体由来の血清を使用することを推奨します)
-
一次抗体の特異性が得られない解決策
実績のある一次抗体を使用してください。可能であればノックダウン/ノックアウト試料をネガティブコントロールとして比較してください。
-
一次/二次抗体濃度が高すぎる、インキュベーション時間が長すぎる、インキュベーション温度が高すぎる解決策
メーカーのプロトコルを参照に、抗体の使用濃度およびインキュベーション時間/温度を最適化してください。
-
二次抗体の交差反応性解決策
二次抗体のアイソタイプコントロールを用いて交差反応性を確認します。
-
洗浄不足解決策
すべての洗浄工程が適切に実施されていることを確認し、必要であれば洗浄を延長します。
-
蛍光退色解決策
顕微鏡技術に適した(退色しにくい)蛍光分子を選択する。
-
シグナルが低く、ノイズが発生する解決策
S/N比を最適化する、例えば、検出に適した明るい蛍光分子を使用する。可能であれば、抗原の発現を促す。
-
高い自家蛍光解決策
染色してないコントロールサンプルで自家蛍光が見られる場合、まず新鮮な固定液を使用してみてください(期限切れのホルマリン液は高い自家蛍光を有している可能性があります)。自家蛍光が低い材質の容器 (ibid マイクロスライドまたはチャンバースライドなど) や封入剤(ibid Mounting Medium / ibid Mounting Medium With DAPIなど)を使用することも有効です。
シグナルが低いまたはシグナルが検出されない
-
サンプルの乾燥解決策
作業中にサンプルが乾燥しないようにする。
-
サンプルの過剰固定によるエピトープ損傷解決策
固定時間の短縮や固定液の変更
-
不適切な透過処理解決策
透過処理を最適化またはスキップする
-
一次抗体が抗原を認識しない解決策
実績ある一次抗体を使用してください。ポジティブコントロール(例えば、過剰発現したサンプル)を用いて抗体が機能していることを確認してください。
-
一次/二次抗体希釈が高すぎる、インキュベーション時間が短すぎる、インキュベーション温度が低すぎる解決策
メーカーのプロトコルを参照し、抗体濃度またはインキュベーション時間/温度を上げる
-
抗原の発現量が低い、発現しない解決策
ポジティブコントロール(過剰発現モデルなど)を使用し、実験系を再考してください。
-
顕微鏡操作が不適切解決策
より感度の高い画像取得方法を検討することが必要です。使用したフィルター/レーザーの設定を確認してください。解消しない場合、より明るい蛍光分子を使用することも考慮すべきです。